Was ist PMTA?
PMTA steht für pre-market tobacco product application. Dies ist ein Antrag auf Prüfung beim FDA, ohne den es in Zukunft nicht mehr erlaubt ist, Vaping-Produkte zu vermarkten oder verkaufen.
Ein Premarket Tobacco Product Application (PMTA) kann von jeder Person für jedes neue Tabakprodukt eingereicht werden, das eine FDA-Vermarktungsverordnung gemäss Abschnitt 910 (b) des Bundesgesetzes über Lebensmittel, Arzneimittel und Kosmetika (FD & C) beantragt. Eine PMTA muss wissenschaftliche Daten liefern, aus denen hervorgeht, dass ein Produkt zum Schutz der öffentlichen Gesundheit geeignet ist. Um eine solche Entscheidung zu treffen und das Marketing zu genehmigen, erwägt die FDA unter anderem:
- Risiken und Vorteile für die gesamte Bevölkerung, einschliesslich Personen, die das vorgeschlagene neue Tabakerzeugnis verwenden würden, sowie Nichtkonsumenten
- ob Personen, die derzeit Tabakerzeugnisse verwenden, mehr oder weniger wahrscheinlich aufhören würden, solche Produkte zu verwenden, wenn das vorgeschlagene neue Tabakerzeugnis verfügbar wäre
- Ob Menschen, die derzeit keine Tabakerzeugnisse konsumieren, mit der Verwendung von Tabakerzeugnissen beginnen, wenn das neue Produkt verfügbar ist
- Die Methoden, Einrichtungen und Kontrollen zur Herstellung, Verarbeitung und Verpackung des neuen Tabakerzeugnisses.
Weshalb gibt es das denn nun?
Das Ziel der PMTA-Vaping-Richtlinien besteht darin, den Zugang Minderjähriger zu Vaping-Produkten zu verringern.
Leider kann das aber auch dazu führen, dass die Vaping-Industrie verschwindet. Es gibt böse Zungen, die behaupten, dass der Abbau der Vaping-Industrie sogar das Ziel ist.
Es ist auch denkbar, dass nur Vaping-Unternehmen, die auch Zigaretten herstellen, überleben werden, da sie eine lange Geschichte und tiefe finanzielle Taschen haben.
Für wen gilt die PMTA?
Kurz gesagt, 99 % aller Vaping-Produkte müssen diesen Prozess durchlaufen. Egal, wie gross ein Geschäft ist, wenn es Dampfprodukte anbieten will, braucht es Genehmigungen. Dies betrifft nicht nur alle Liquids, sondern auch viele andere Produkte, an die man gar nicht denkt: vom Driptip bis Vaporizer ist alle betroffen.
Einzige Ausnahme sind Produkte, die in der gleichen Form wie heute schon vor 2007 auf dem Markt waren – diese bekommen eine Sondergenehmigung. Wir alle wissen, dass es zu diesem Zeitpunkt noch gar keine Vaping-Produkte auf dem Markt gab und von dieser Regelung einzig andere Tabakprodukte, wie z. B. Zigaretten, profitieren.
Was muss denn eingereicht werden?
Die Liste ist umfangreich und kann beim FDA bezogen werden.
Grundlegend sind folgende Angaben zwingend:
- Produktmuster und Etiketten: Die FDA fordert Muster von Produkten zum Testen an, und Hersteller müssen auch Muster von Etiketten senden, damit sie analysiert und geprüft werden können, um festzustellen, ob sie angemessen sind.
- Wissenschaftliche Analysen: Neben den Proben müssen die Hersteller auch Testergebnisse einsenden, die sie an ihren Produkten und deren gesundheitlichen Auswirkungen durchgeführt haben.
- Herstellungsprozesse: Unternehmen müssen detaillierte Beschreibungen der für das Produkt verwendeten Herstellungsprozesse einschliesslich Informationen zu den verwendeten Einrichtungen einsenden.
- Funktionsprinzipien: Eine Beschreibung, wie Verbraucher das Produkt verwenden, mit welchen anderen Produkten es verwendet werden kann und wie Kunden das Produkt modifizieren können, um die Leistung oder die Inhaltsstoffe anzupassen.
- Verwendungsmuster: Beschreibt im Wesentlichen, wie Kunden das Produkt verwenden, einschliesslich der Häufigkeit, ob sie dazu neigen, auch andere Tabakerzeugnisse zu verwenden, und welche Trends im Laufe der Zeit verwendet werden.
- Appell- und Verbraucherwahrnehmung: Grundsätzlich, wie Kunden Ihr Produkt sehen und ob diese Wahrnehmungen die Attraktivität des Produkts für Jugendliche beeinflussen
- Chancen für Missbrauch: Dies schliesst andere Faktoren ein, die sich auf den realen Gebrauch beziehen, z. B. wie sich dies auf Menschen mit normalem Gebrauch auswirkt (d. H. Mit dem Rauchen aufhören) oder auf Missbrauch (d. H. Dient Ihr Produkt als Gateway für Nicht-Nikotinkonsumenten).
Die Frist
Ursprünglich wurde als Frist für diese Prüfung der 8.8.2018 gesetzt. Diese wurde aber dann verschoben ins Jahr 2022, weil noch niemand bereit war. Dies wiederum führte zu massiver Unruhe auf dem Markt, sodass die Frist dann wieder angepasst wurde auf den 12. Mai 2020. Zu guter Letzt wurde die Frist erneut verschoben und tritt nun effektiv in Kraft am 9.9.2020.
Was kostet einen Hersteller denn die Prüfung?
Der PMTA-Prozess sollte nie wirklich einfach sein. Das Ziel war vor allem, Tabakunternehmen die Markteinführung neuer Produkte zu erschweren. Die oben aufgeführten Anforderungen sind in Bezug auf die erforderlichen Nachweise und Unterlagen anspruchsvoll genug (wie argumentieren Sie beispielsweise, dass Ihr Mod „zum Schutz der öffentlichen Gesundheit geeignet“ ist).
Das Erbringen aller Nachweise und damit die effektiven Kosten liegen aktuell zwischen 150'000 und 450'000 USD. Dies gilt für jedes Produkt, das auf dem Markt bleiben soll, einschliesslich verschiedener Liquid Aromen und Nikotinstärken.
Was bedeutet das für die Hersteller?
Für viele Unternehmen ist dies eine unüberwindbare Hürde, und sie müssen zweifellos den Laden schliessen. Gerade kreative kleinere Firmen haben kaum eine Chance, auf dem Markt zu bestehen.
Einige Hersteller haben sich rechtzeitig auf diese Gesetzgebung eingestellt. Als Vorzeigebeispiel gilt hier Black Note. Der Grossteil der Besorgnis über das Dampfen dreht sich um das Dampfen von Jugendlichen und insbesondere um aromatisierte E-Liquids. Bei Black Note liegt der Fokus auf Tabakaromen mit einem klaren Fokus auf erwachsene Kunden und keinem wirklichen Spielraum, in dem irgendjemand etwas anderes behaupten kann. Darüber hinaus entsprechen deren Herstellungsprozesse bereits dem Standard und ihr Marketing verwendet keine potenziell problematischen Bilder. Dank solcher Voraussicht und ausreichend Kapital zum Einreichen aller Anträge gehört Black Note zweifelsohne zu einer Marke, die erhalten bleibt.
Vieles rund um diese Anträge ist nicht geklärt (z. B. was passiert bei einer Ablehnung? Kann man noch korrigieren?) und die Zulassungsstelle ist bereits jetzt mit der Anzahl Anträgen überfordert. Aktuell erfährt man nicht, wann die Prüfung bearbeitet wird und wann dann das Produkt bei Bestehen auf den Markt kommen kann bzw. dort bleiben darf.
In der Praxis sieht man ironischerweise, dass Tabakunternehmen zu den Besten gehören, um die Anforderungen der Verordnung zu erfüllen. Da bereits so viel Infrastruktur aufgebaut ist und viel Erfahrung in der Einhaltung von Vorschriften vorhanden ist, werden sie wahrscheinlich nicht so stark von den kommenden Regeln wie die vielen kleinen und mittleren unabhängigen Unternehmen in der Branche betroffen sein.
Was bedeutet dies für Dampfer?
Die Verpackung ist wichtig. Das Produkt ist wichtig. Die Komponente, die das Produkt enthält, ist wichtig. Während dieses Bewerbungsprozesses wird jedes Detail geprüft. Das ist natürlich toll, denn so weiss man ganz genau, dass das gewählte Produkt allen Kriterien entspricht und höchste Qualität ausweist.
Viele kleinere Unternehmen werden aber vom Markt verschwinden, da sie die hohen Kosten für die PMTA gar nicht stemmen können. Das bedeutet, dass viele kreative, spannende und durchaus auch qualitativ hochwertige Produkte nicht mehr erhältlich sein werden und zukünftige Entwicklungen massiv gebremst werden.
Marktbestimmend werden dann die grossen Unternehmen sein, die es sich leisten können, teure Verfahren zur Bewilligung einzugehen. Vor allem die Tabakindustrie, die mittlerweile überall in der Vape-Branche ihre Finger drin hat, wird dies freuen. Diese Unternehmen haben jahrzehntelang bewiesen, dass sie kein Interesse an einer Verbesserung ihrer Produkte in Richtung gesündere Lebensweise haben – nun können sie diesen Gedanken auch für die eigentlich innovative E-Zigaretten-Branche nutzen.
Aber immerhin – Ziel erreicht, Jugend geschützt. Oder?
Ein Narr, der dabei Böses denkt… Der amerikanische Markt für E-Zigaretten hat sich tatsächlich in den letzten Monaten gewandelt: in Vapeshops gibt es kaum noch Geräte zu kaufen – stattdessen setzt man dort immer mehr auf den Verkauf von Cannabis, der vielerorts mittlerweile legal ist. Während die Tankstellen früher allesamt eine Auswahl an E-Zigaretten (oftmals Pod-Systeme) mit verschiedensten Aromen angeboten haben, findet man in deren Regalen heute nur noch wenige Anbieter und diese auch nur als Tabak oder Menthol-Variante.
Doch jetzt kommt’s: überall findet man nun sogenannte disposables. Das sind Einwegzigaretten, die man leerdampft und dann wegwirft. Umwelttechnisch muss dazu schon mal gar nichts gesagt werden. Aber dass diese Wegwerf-Dampfis, die es in zahlreichen Geschmacksrichtungen gibt, ganz besonders auch jüngere Dampfer ansprechen, überrascht nicht wirklich. Und da diese erstaunlicherweise keine PMTA erfüllen müssen, ist ein gewisser Erfolg vorprogrammiert.
Bis es dann wieder der grossen Tabaklobby gelingen wird, auch diese Produkte vom Markt zu verdrängen. Damit man selbst weiterhin fleissig verdienen kann an den Rauchern und Dampfern – und das sogar mit staatlicher Unterstützung, bravo!
Und für alle, die noch mehr wissen wollen
Wir führen hier gerne unzensiert auf, was das FDA zur PMTA so schreibt:
PMTA vorbereiten
• Eine PMTA umfasst (gemäß Abschnitt 910 (b) (1)):
o Vollständige Berichte über alle Informationen, die dem Antragsteller veröffentlicht oder bekannt sind oder denen der Antragsteller vernünftigerweise bekannt sein sollte, in Bezug auf Untersuchungen, die durchgeführt wurden, um die Gesundheitsrisiken eines solchen Tabakerzeugnisses aufzuzeigen, und ob dieses Tabakerzeugnis ein geringeres Risiko darstellt als andere Tabakerzeugnisse.
o Vollständige Angabe der Komponenten, Inhaltsstoffe, Zusatzstoffe und Eigenschaften sowie des Grundsatzes oder der Funktionsprinzipien.
o Vollständige Beschreibung der Methoden sowie der Einrichtungen und Kontrollen, die für die Herstellung, Verarbeitung und gegebenenfalls Verpackung und Installation verwendet werden.
o Gegebenenfalls ein Verweis auf einen Tabakerzeugnisstandard. Wenn ja, entweder:
Angemessene Informationen, um nachzuweisen, dass ein solcher Aspekt eines solchen Tabakerzeugnisses diesen Tabakerzeugnisstandard vollständig erfüllt, oder
Angemessene Informationen, um Abweichungen von diesem Standard zu rechtfertigen
Proben des Tabakerzeugnisses nach Bedarf
Muster der vorgeschlagenen Kennzeichnung
Zusätzliche anwendbare erforderliche Elemente gemäss der endgültigen Regel. Verweigern Sie die Annahme von Verfahren für die Einreichung von Tabakwaren vor dem Inverkehrbringen
• Die FDA empfiehlt die folgende Struktur:
o Anschreiben und Verwaltungsinformationen
o Inhaltsverzeichnis
o Zusammenfassungen
o Produktbeschreibung und Herstellung (falls zutreffend)
o Nicht klinische Informationen (falls zutreffend)
o Klinisch - Auswirkungen des Produkts auf die Gesundheit des Einzelnen (falls zutreffend)
o Klinische Auswirkungen des Produkts auf die Gesundheit der Bevölkerung (falls zutreffend)
o Umweltauswirkungen
• So senden Sie eine PMTA
o Online
1. Fordern Sie ein Industry Account Manager (IAM) -Konto an, um ein CTP Portal-Konto einzurichten, falls Ihr Unternehmen noch kein IAM hat.
2. Bereiten Sie Ihre Einreichung elektronisch mit der eSubmitter-Software der FDA und der eSubmitter-Vorlage „CTP Transmittal Form“ vor.
3. Online über das CTP-Portal einreichen.
Hinweis: Das CTP-Portal bietet mehr Funktionen als das ESG. CTP empfiehlt die Verwendung des CTP-Portals. Wenn Sie jedoch bereits über ein ESG WebTrader-Konto verfügen, können Sie damit Dokumente an CTP senden.
o Per Post senden: Wenn Sie nicht online senden können, senden Sie die E-Mails an das Document Control Center von CTP.
Bitte beachten Sie, dass die vorgeschlagene Regel für PMTA nach Fertigstellung einen Antragsteller dazu verpflichten würde, eine PMTA und alle unterstützenden und zugehörigen Dokumente elektronisch in einem Format einzureichen, das von der FDA verarbeitet, überprüft und archiviert werden kann. Antragsteller, die diese Anforderung nicht erfüllen können, müssen vor der Einreichung eines PMTA einen Verzicht bei der FDA beantragen und erhalten.
• Mit diesen Anweisungen können auch Änderungen eingereicht werden. Jede Änderung sollte Folgendes enthalten: ein Anschreiben mit der (den) Tracking-Nummer (n) der PMTA in der Betreffzeile. Befolgen Sie bei der Beantwortung eines Mangels (einschliesslich Anfragen) die Anweisungen in Ihrem Mängelschreiben.
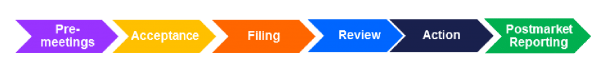
PMTA-Überprüfungsprozess
• Presubmission Meetings: Ein freiwilliges formelles Treffen zwischen dem Antragsteller und der FDA, um eine geplante PMTA-Einreichung für ein Tabakerzeugnis zu erörtern. Weitere Informationen finden Sie unter Treffen mit Industrie und Ermittlern.
o Ausgabe
Sitzung erteilt Brief oder
Ablehnungsschreiben
Sitzungsprotokoll (wenn die Sitzung gewährt und abgehalten wird)
• Abnahmeprüfung: Eine administrative Prüfung, die sicherstellt, dass das Produkt unter die Zuständigkeit des Zentrums für Tabakprodukte fällt und bestätigt, dass die gesetzlichen und behördlichen Anforderungen eines Antrags auf der Grundlage von Abschnitt 910 des FD & C-Gesetzes und den in § 1105.10 festgelegten Kriterien erfüllt sind.
o Ausgabe
Zulassungsbescheid oder
Verweigern Sie die Annahme eines Briefes (RTA)
• Überprüfung der Einreichung1: Eine vorläufige wissenschaftliche Überprüfung, die sicherstellt, dass der Antrag alle Punkte gemäss Abschnitt 910 (b) (1) enthält.
o Ausgabe
Anmeldebrief oder
RTF-Brief ablehnen
• Inhaltliche Überprüfung: FDA-Bewertung der wissenschaftlichen Informationen und Daten in einem Antrag sowie Empfehlungen des wissenschaftlichen Beratungsausschusses für Tabakprodukte (TPSAC), falls der Antrag weitergeleitet wurde.
o Ausgabe
Mängelbrief: Für eine Entscheidung über die Genehmigung für das Inverkehrbringen sind zusätzliche Informationen erforderlich. Die Antragsteller haben 180 Tage Zeit, um auf diese Art von Schreiben zu antworten.
Anforderungsschreiben für Umweltinformationen: Die FDA hat eine wissenschaftliche Entscheidung getroffen, um einen Marketingauftrag zu unterstützen. Der Antragsteller muss jedoch Informationen aus Umweltgründen bereitstellen, bevor ein Marketingauftrag erteilt werden kann.
• Aktion:
o Ausgabe
Marketingauftragsschreiben oder
Kein Marketingauftragsschreiben
• Postmarket-Berichterstattung: Fordert die Antragsteller auf, Aufzeichnungen zu erstellen und zu führen und Berichte zu erstellen, die die FDA nach Bedarf benötigt, um festzustellen oder zu erleichtern, ob Gründe für die Rücknahme oder vorübergehende Aussetzung einer vom Marketing erteilten Bestellung vorliegen.
 Kostenloser Versand ab CHF 50
Kostenloser Versand ab CHF 50  Ladengeschäfte in Zug, Schlieren und Affoltern
Ladengeschäfte in Zug, Schlieren und Affoltern 


 Ladengeschäfte in Zug, Schlieren und Affoltern
Ladengeschäfte in Zug, Schlieren und Affoltern